Альдегиды и кетоны. Формула, получение, применение. Альдегиды и кетоны — номенклатура, получение, химические свойства
Альдегиды и кетоны относятся к карбонильным органическим соединениям. Карбонильными соединениями называют органические вещества, в молекулах которых имеется группа >С=О (карбонил или оксогруппа).
Общая формула карбонильных соединений:
Функциональная группа –СН=О называется альдегидной. Кетоны - органические вещества, молекулы которых содержат карбонильную группу, соединенную с двумя углеводородными радикалами. Общие формулы: R 2 C=O, R–CO–R" или
|
|
|
Модели простейших карбонильных соединений |
||
|
Название | ||
|
Формальдегид (метаналь) |
H 2 C=O | |
|
Ацетальдегид (этаналь) |
СH 3 -CH=O | |
|
Ацетон (пропанон) |
(СH 3 ) 2 C=O |
|
Номенклатура альдегидов и кетонов.
Систематические названия альдегидов строят по названию соответствующего углеводорода и добавлением суффикса -аль . Нумерацию цепи начинают с карбонильного атома углерода. Тривиальные названия производят от тривиальных названий тех кислот, в которые альдегиды превращаются при окислении.
|
Формула |
Название |
|
|
систематическое |
тривиальное |
|
|
H 2 C=O |
метаналь |
муравьиный альдегид (формальдегид) |
|
CH 3 CH=O |
этаналь |
уксусный альдегид (ацетальдегид) |
|
(CH 3 ) 2 CHCH=O |
2-метил-пропаналь |
изомасляный альдегид |
|
CH 3 CH=CHCH=O |
бутен-2-аль |
кротоновый альдегид |
Систематические названия кетонов несложного строения производят от названий радикалов (в порядке увеличения) с добавлением слова кетон . Например: CH 3 –CO–CH 3 - диметилкетон (ацетон); CH 3 CH 2 CH 2 –CO–CH 3 - метилпропилкетон. В более общем случае название кетона строится по названию соответствующего углеводорода и суффикса -он ; нумерацию цепи начинают от конца цепи, ближайшего к карбонильной группе (заместительная номенклатура ИЮПАК). Примеры: CH 3 –CO–CH 3 - пропанон (ацетон); CH 3 CH 2 CH 2 –CO–CH 3 - пентанон- 2; CH 2 =CH–CH 2 –CO–CH 3 - пентен-4-он- 2.
Изомерия альдегидов и кетонов .
Для альдегидов и кетонов характерна структурная изомерия .
Изомерия альдегидов :
|
изомерия углеродного скелета, начиная с С 4 |
|
|
межклассовая изомерия с кетонами, начиная с С 3 |
|
|
циклическими оксидами (с С 2) |
|
|
непредельными спиртами и простыми эфирами (с С 3) |
|
|
Изомерия кетонов : углеродного скелета (c C 5) |
|
|
положения карбонильной группы (c C 5) |
|
межклассовая изомерия (аналогично альдегидам).
Строение карбонильной группы C=O.
Свойства альдегидов и кетонов определяются строением карбонильной группы >C=O.

Связь С=О сильно полярна. Ее дипольный момент (2,6-2,8D) значительно выше, чем у связи С–О в спиртах (0,70D). Электроны кратной связи С=О, в особенности более подвижные -электроны, смещены к электроотрицательному атому кислорода, что приводит к появлению на нем частичного отрицательного заряда. Карбонильный углерод приобретает частичный положительный заряд.

Поэтому углерод подвергается атаке нуклеофильными реагентами, а кислород - электрофильными, в том числе Н + .
В молекулах альдегидов и кетонов отсутствуют атомы водорода, способные к образованию водородных связей. Поэтому их температуры кипения ниже, чем у соответствующих спиртов. Метаналь (формальдегид) - газ, альдегиды С 2 –C 5 и кетоны С 3 –С 4 - жидкости, высшие - твердые вещества. Низшие гомологи растворимы в воде, благодаря образованию водородных связей между атомами водорода молекул воды и карбонильными атомами кислорода. С увеличением углеводородного радикала растворимость в воде падает.
Реакционные центры альдегидов и кетонов
sp 2 -Гибридизованный атом углерода карбонильной группы образует три σ-связи, лежащие в одной плоскости, и π-связь с атомом кислорода за счет негибридизованной p-орбитали. Вследствие различия в электроотрицательности атомов углерода и кислорода π-связь между ними сильно поляризована (рис. 5.1). В результате на атоме углерода карбонильной группы возникает частичный положительный заряд δ+, а на атоме кислорода - частичный отрицательный заряд δ-. Поскольку атом углерода электронодефицитен, он представляет собой центр для нуклеофильной атаки.
Распределение электронной плотности в молекулах альдегидов и кетонов с учетом передачи электронного влияния электроно-

Рис. 5.1. Электронное строение карбонильной группы
дефицитного атома углерода карбонильной группы по σ-связям представлено на схеме 5.1.
Схема 5.1. Реакционные центры в молекуле альдегидов и кетонов

В молекулах альдегидов и кетонов присутствует несколько реакционных центров:
Электрофильный центр - атом углерода карбонильной группы - предопределяет возможность нуклеофильной атаки;
Основный центр - атом кислорода - обусловливает возможность атаки протоном;
СН-кислотный центр, атом водорода которого обладает слабой протонной подвижностью и может, в частности, подвергаться атаке сильным основанием.
В целом альдегиды и кетоны обладают высокой реакционной способностью.
Альдегидами называют органические вещества, относящиеся к карбонильным соединениям, содержащим функциональную группу -СОН, которая именуется карбонильной группой.
В зависимости от характера углеводородного скелета молекулы альдегиды бывают предельными, непредельными и ароматическими. Их молекулы могут также включать атомы галогенов или дополнительные функциональные группы. Общая формула насыщенных альдегидов имеет вид C n H 2 n O. В соответствии с номенклатурой ИЮПАК названия их оканчиваются суффиксом -аль.
Окисление альдегидов имеет важное значение в промышленности, поскольку они довольно легко превращаются в карбоновые кислоты. Окислителями в этом случае могут послужить гидроксид меди, оксид серебра или даже кислород воздуха.
Строение карбонильной группы
Электронное строение двойной связи в группе С=О характеризуется образованием одной σ-связи и еще одной π-связи. Атом С находится в состоянии sp 2 -гибридизации, молекула плоского строения с валентными углами между связями около 120 0 . Отличие двойной связи в этой функциональной группе заключено в том, что она расположена между атомом углерода и весьма электроотрицательным атомом кислорода. В результате электроны притянуты к атому О, а значит, эта связь очень сильно поляризована.
Содержание в альдегидной группе такой поляризованной двойной связи можно назвать главной причиной высокой реакционноспособности альдегидов. Для альдегидов наиболее характерны реакции присоединения атомов или их групп по С=О связи. И легче всего протекают реакции нуклеофильного присоединения. Также для альдегидов типичны реакции с участием атомов Н из функциональной группы альдегидов. Из-за электроноакцепторного влияния группы С=О происходит повышение полярности связи. Это в свою очередь является причиной относительно легкого окисления альдегидов.
Отдельные представители альдегидов
Формальдегид (муравьиный альдегид или метаналь) СН 2 О является газообразным веществом с весьма острым запахом, который получают обычно пропусканием смеси паров метанола с воздухом через раскаленную сетку из медной или серебряной сетки. Его 40%-й водный раствор называется формалином. Формальдегид легко вступает в реакции, многие из которых лежат в основе промышленного синтеза целого ряда важных веществ. Его используют и для получения пентаэритрита, многих лекарственных веществ, различных красителей, для дубления кожи, в качестве дезинфицирующего и дезодорирующего средства. Формальдегид довольно токсичен, его ПДК в воздухе составляет 0,001 мг/л.
Ацетальдегид (уксусный альдегид, этаналь) СН 3 СОН является бесцветной жидкостью с удушающим запахом, который при разбавлении его водой приобретает фруктовый аромат. Ацетальдегид обладает всеми основными свойствами альдегидов. Окислением уксусного альдегида производят огромные объемы уксусной кислоты и уксусного ангидрида, разнообразных фармацевтических препаратов.
Акролеин (пропеналь) CH 2 =CH-СОН, простейший ненасыщенный альдегид является бесцветной легколетучей жидкостью. Его пары сильно раздражают слизистые глаз и верхних дыхательных путей. Очень ядовит, ПДК его содержания в воздухе составляет 0,7 мг/м 3 . Пропеналь - промежуточный продукт синтеза некоторых полимеров, необходим в производстве отдельных лекарственных препаратов.

Бензальдегид (бензойный альдегид) С 6 Н 5 СОН является бесцветной желтеющей при хранении жидкостью с ароматом Он довольно быстро окисляется воздухом до бензойной кислоты. Содержится в эфирных маслах растений (нероли, пачулей), а в виде глюкозида - в ядрах косточек горького миндаля, вишни, абрикоса и персика. Как душистое вещество его применяют в парфюмерии, в виде компонента пищевых эссенций, как сырье для синтеза других душистых веществ (коричного альдегида, жасминальдегида).
Реакция серебряного зеркала
Окисление альдегидов оксидом серебра является самой показательной качественной реакцией на соответствующую форму функциональной группы. Свое название эта реакция получила благодаря тонкому серебряному налету на стенках пробирки, образующемуся в ходе этой реакции.
Суть ее заключается во взаимодействии альдегида R-СОН с аммиачным раствором оксида серебра(I), который представляет собой растворимое комплексное соединение OH и носит название реактив Толленса. Реакцию осуществляют при температурах, близких к температуре кипения воды (80-100 °С). При этом происходит окисление альдегидов до соответствующих им карбоновых кислот, а окислитель восстанавливается до металлического серебра, выпадающего в осадок.
Приготовление реактивов
Для качественного определения группы -СОН в альдегидах сначала готовят комплексное соединение серебра. Для этого в пробирку наливают немного раствора аммиака (гидроксида аммония) в воде и следом небольшое количество нитрата серебра. При этом образующийся осадок оксида серебра тут же исчезает:
2AgNO 3 + 2NH 3 + Н 2 О -> Ag 2 O↓ + 2NH 4 NO 3
Ag 2 O + 4NΗ 3 + Η 2 О -> 2ОΗ
Более надежные результаты дает реактив Толленса, приготовленный с добавлением щелочи. Для этого 1 г AgNO 3 растворяют в 10 г дистиллированной воды и добавляют равный объем концентрированного гидроксида натрия. В результате выпадает осадок Ag 2 O, который исчезает при добавлении концентрированного раствора гидроксида аммония. Использовать для проведения реакции нужно только свежеприготовленный реактив.

Механизм реакции
Реакции серебряного зеркала соответствует уравнение:
2OΗ + НСОΗ -> 2Ag↓ + ΗCOONΗ 4 + 3NΗ 3 + Н 2 О
Стоит отметить, что для альдегидов такое взаимодействие изучено недостаточно. Механизм данной реакции неизвестен, но предполагается радикальный или же ионный вариант окисления. По гидроксиду диамминсеребра вероятнее всего реализуется присоединение с образованием серебряной соли диола, от которого затем отщепляется серебро с образованием карбоновой кислоты.
Для успешного проведения опыта чрезвычайно важна чистота используемой посуды. Связано это с тем, что образующиеся в ходе опыта коллоидные частицы серебра должны прицепиться к поверхности стекла, создав зеркальную поверхность. В присутствии малейших загрязнений оно будет выпадать в виде серого хлопьевидного осадка.
Для очистки емкости следует использовать растворы щелочей. Так, для этих целей можно взять раствор NaOH, который нужно смыть большим объемом дистиллированной водой. На поверхности стекла не должно присутствовать жировых следов и механических частиц.
Окисление гидроксидом меди
Реакция окисления альдегидов гидроксидом меди (II) также довольно эффектна и эффективна в определении типа функциональной группы. Протекает она при температуре соответствующей кипячению реакционной смеси. При этом альдегиды восстанавливают двухвалентную медь в составе реактива Фелинга (свежеприготовленный аммиачный раствор Cu(OH) 2) до одновалентной. Сами же они окисляются по причине внедрения атома кислорода по связи С-Η (степень окисления С изменяется с +1 на +3).
Визуально за ходом реакции можно проследить по изменению окраски смеси растворов. Голубоватый осадок гидроксида меди постепенно превращается желтый, соответствующий гидроксиду меди одновалентной и дальнейшее появление яркого красного осадка Cu 2 O.
Этому процессу соответствует уравнение реакции:
R-СОН + Cu 2+ + NaOH + Н 2 О -> R-COONa + Cu 2 O + 4Н +

Действие реактивом Джонса
Стоит отметить, что на альдегиды такой реактив действует наилучшим образом. В этом случае окисление не требует нагревания и проводится при температуре 0-20 °С в течение довольно короткого отрезка времени, а выход продуктов составляет больше 80%. Главным недостатком реагента Джонса состоит в отсутствии высокой избирательности в отношении других функциональных групп, да к тому же кислая среда порой приводит к изомеризации или деструкции.
Реагент Джонса представляет собой раствор оксида хрома (VI) в разбавленной и ацетоне. Его также можно получить из дихромата натрия. При окислении альдегидов образуются под действием этого реактива карбоновые кислоты.
Промышленное окисление кислородом
Окисление ацетальдегида в промышленности осуществляют воздействием кислорода в присутствии катализаторов - ионов кобальта или марганца. Сначала образуется надуксусная кислота:
СН 3 -СОН + О 2 -> СН 3 -СОООН
Она в свою очередь взаимодействует со второй молекулой уксусного альдегида и через перекисное соединение дает две молекулы уксусной кислоты:
СН 3 -СОООН + СН 3 -СОН -> 2СН 3 -СООН
Окисление ведется при температуре 60-70 °С и давлении 2·10 5 Па.
Взаимодействие с раствором йода
Для окисления альдегидных групп иногда применяется раствор йода в присутствии щелочи. Особое значение этот реактив имеет в процессе окисления углеводов, поскольку действует очень избирательно. Так под его влиянием D-глюкоза превращается в D-глюконовую кислоту.

Йод в присутствии щелочей образует гипойодид (весьма сильный окислитель): I 2 + 2NaOΗ -> NaIO + NaI + Н 2 О.
Под действием гипойодида формальдегид превращается в метановую кислоту: ΗСОΗ + NaIO + NaOΗ -> ΗCOONa + NaI + Н 2 О.
Окисление альдегидов йодом используют в аналитической химии для определения количественного их содержания в растворах.
Окисление диоксидом селена
В отличие от предыдущих реактивов, под действием диоксида селена альдегиды превращаются в дикарбонильные соединения, а из формальдегида образуется глиоксаль. Если рядом с карбонилом расположены метиленовые или метильные группы, то они могут превращаться в карбонильные. Как растворитель для SeO2 обычно используют диоксан, этанол или ксилол.
По одной из методик реакцию проводят в трехгорлой колбе, соединенной с мешалкой, термометром и обратным холодильником. К исходному веществу, взятому в количестве 0,25 моль, каплями прибавляют раствор 0,25 моль диоксида селена в 180 мл диоксана, а также 12 мл Н 2 О. Температура не должна превышать 20 °C (при необходимости колбу охлаждают). После этого при постоянном перемешивании раствор кипятят в течении 6 часов. Далее горячий раствор фильтруют для отделения селена и промывают осадок диоксаном. После вакуумной отгонки растворителя остаток фракционируют. Основную фракцию отбирают в широком температурном интервале (20-30 °C) и повторно ректифицируют.

Аутоокисление альдегидов
Под действием кислорода воздуха при комнатной температуре окисление альдегидов происходит очень медленно. Главными продуктами этих реакций являются соответствующие карбоновые кислоты. Механизм аутоокисления родственен промышленному окислению этаналя до уксусной кислоты. Одним из промежуточных продуктов является надкислота, которая взаимодействует с еще одной молекулой альдегида.
Благодаря тому, что этот тип реакций ускоряется под действием света, перекисей, и следов тяжелых металлов, можно сделать вывод о ее радикальном механизме. Формальдегид в водных растворах значительно хуже своих собратьев окисляется воздухом, из-за того, что существует в них в виде гидратированного метиленгликоля.

Окисление альдегидов перманганатом калия
Наиболее успешно эта реакция происходит в Визуально оценить ее прохождение можно по потере интенсивности и полному обесцвечиванию розовой окраски раствора марганцовки. Реакция проходит при комнатной температуре и нормальном давлении, поэтому она не требует особых условий. Достаточно в пробирку налить 2 мл формальдегида и 1 мл подкисленного серной кислотой Пробирку с раствором нужно осторожно встряхнуть для перемешивания реагентов:
5СН 3 -СОН + 2KMnO 4 + 3H 2 SO 4 = 5СН 3 -СООН + 2MnSO 4 + K 2 SO 4 + 3Н 2 О
Если ту же реакцию вести при повышенных температурах, то метаналь легко окисляется до углекислого газа:
5СН 3 -СОН + 4KMnO 4 + 6H 2 SO 4 = 5СО 2 + 4MnSO 4 + 2K 2 SO 4 + 11Н 2 О
Что вообще такое альдегиды? Ответ на этот вопрос не так прост, как может показаться на первый взгляд. Спросите об этом любителя парфюмерии со стажем - скорее всего он вам расскажет про синтетические материалы с трудноописуемым запахом, которые сделали аромат таким необычным, абстрактным и новаторским.
Химик или даже обычный одиннадцатиклассник, регулярно посещавший уроки химии, тоже не будет особо раздумывать и скажет, что альдегиды - это класс органических соединений, содержащие группу -СНО , которую называют альдегидной группой. У всех альдегидов есть общие химические свойства, например, они легко окисляются с образованием соответствующих кислот. На этом основана реакция серебряного зеркала - помните, когда пробирку нагревают и на поверхности стекла появляется блестящий металлический слой. Само слово «альдегид», придуманное немецким химиком Юстасом фон Либихом, является сокращенным alcohol dehydrogenatum, что означает «спирт без водорода ».
В тривиальных названиях альдегидов часто* (см.сноску) присутствует либо само слово «альдегид», либо суффикс -аль , например, «пельменный альдегид», «жабальдегид», «кочергаль». Такие вещества, как ванилин и гелиотропин - тоже альдегиды с химической точки зрения. Вообще в арсенале парфюмера огромное количество альдегидов с совершенно различными запахами: мелональ пахнет дыней, адоксаль пахнет морем и яичным белком, цитронеллаль - лемонграссом, лираль - ландышем, триплаль - зелёной травой. Есть цикламенальдегид, коричный альдегид, анисовый, куминовый, мандариновый.
Хорошо, спросите вы, причём тут Шанель? Если альдегидов так много и все они пахнут по-разному, то что же это за такая «альдегидная нота», чем она пахнет и какие конкретно альдегиды входят в состав Chanel №5? Помните хармсовские «Анекдоты из жизни Пушкина»: «Пушкин очень полюбил Жуковского и стал называть его по-приятельски Жуковым»? То, что парфюмеры часто называют по-приятельски просто альдегидами, на самом деле некий подвид и частный случай: насыщенные алифатические или так называемые жирные альдегиды. Их принято называть по числу атомов углерода в молекуле. У «альдегида С-7», или гептаналя , - семь атомов углерода, у «альдегида С-10», деканаля , как нетрудно догадаться, десять.
В состав Chanel №5 входит смесь из альдегидов "С-11 undecylic" или "С-110" (ундеканаля), "С-11 undecylenic" (10-ундеценаля) и С-12 (додеканаля). Стоит отметить, что альдегиды появились в составе духов задолго до возникновения этого легендарного аромата [Chanel №5 была выпущена в 1921 году ]. Многие историки парфюмерии сходятся на том, что впервые альдегиды использовались при создании , вернее, его переиздания 1905 года, созданное парфюмером Пьером Армижаном (Pierre Armigeant). Есть альдегиды и в (1912), и в Bouquet de Catherine (1913) московской фабрики Alphonse Rallet & Co, созданные, как и Сhanel №5, парфюмером Эрнестом Бо (кстати говоря, коренным москвичом). Но именно Шанель, несомненно, стала главным альдегидным ароматом всех времен и народов, породив огромное количество подражаний и копий.

Жирные альдегиды объединяет характерный восковой запах, похожий на запах задутой свечки (собственно, этот свечной запах и обусловлен жирными альдегидами, продуктами неполного сгорания парафина). Запах у жирных альдегидов очень интенсивный и резкий, приятным он становится при разбавлении до 1% или меньше. Запах деканаля (С-10) имеет оттенок цедры, запах альдегида С-12 имеет нюансы лилии и фиалки. У простейших альдегидов, формальдегида и ацетальдегида, запах крайне резкий и довольно неприятный (тем не менее даже ацетальдегид используется флейвористами и входит в состав некоторых вкусоароматичских добавок), у гексаналя (альдегида С-6) уже можно различить сравнительно приятные зеленые и яблочные аспекты. Жирные альдегиды, у которых в цепочке 15 атомов углерода и больше, уже практически лишены запаха.
У запаха жирных альдегидов есть ещё одно общее свойство - некая «мылкость». Альдегиды давно и активно используются для отдушки мыла по причине своей невысокой стоимости, интенсивности запаха и способности хорошо маскировать неприятные оттенки запаха мыльной основы. Часто альдегидный запах ассоциируется с абстрактной чистотой или с ощущением от свежевыглаженного белья.

Ещё один важный момент, на который стоит отдельно обратить внимание - альдегиды не являются чем-то искусственным, результатом труда человека. Многие из них широко встречаются в природе. Деканаль, например, содержится в эфирных маслах цитрусовых (в апельсиновом до 4%!), хвойных и многих цветочных растений, много его в эфирном масле кориандра. Ненасыщенные алифатические альдегиды тоже повсеместно встречаются в природе, они обладают ещё более интенсивным запахом, например, (E)-2-деценаль отвечает за характерный запах кинзы, он же действительно часто присутствует в «химическом оружии» клопов, а эпоксипроизводное, транс-4,5-эпокси-(Е)-2-деценаль, обуславливает характерный запах крови, который и придаёт ей выраженный металлический аспект. Именно по запаху этого вещества хищники выслеживают свою добычу.
На волне успеха первых цветочно-альдегидных ароматов химики неустанно работали над синтезом новых материалов с похожими ольфакторными свойствами. В 1905 году французы E.E.Blaise и L.Huillon (Bull.Soc.Chim.Fr. 1905, 33, 928) синтезировали гамма-ундекалактон, чуть позже, в 1908 году, аналогичную работу опубликовали и два русских химика А.А. Жуков и П.И. Шестаков (ЖРХО 40, 830, 1908). Это соединением обладало интересным ароматом, напоминающим запах разогретого на солнце спелого персика - фруктовым, восковым и несколько кокосово-сливочным.
Производители решили продавать это вещество под названием «альдегид С-14», чтобы с одной стороны удовлетворить жажду парфюмеров в новых «альдегидах с цифрами», а с другой стороны ввести в заблуждение конкурентов, ведь на самом деле с химической точки зрения это был не альдегид, а лактон (циклический сложный эфир), да и атомов в молекуле у этого соединения не 14, а 11. Как в анекдоте, «не в шахматы, а в преферанс, не выиграл, а проиграл».

Так называемый «альдегид С-14» с огромным успехом в 1919 году дебютировал в аромате Guerlain Mitsouko, а чуть позже появились новые похожие материалы: «альдегид C-16 (клубничный)», «альдегид C-18 (кокосовый)», «альдегид C-20 (малиновый)» и некоторые другие. Вот и получается, что с одной стороны чуть ли не каждое третье душистое вещество является альдегидом, а с другой стороны - некоторые самые главные альдегиды вовсе никакие и не альдегиды.
* Химики пользуются несколькими типами названий. Первый тип - систематические, или номенклатурные. Номенклатурное название - это своего рода шифр, алгоритм, благодаря которому можно воссоздать структуру вещества, то есть понять какие атомы и каким образом соединены внутри молекулы. Каждому названию соответствует единственная структура и наоборот - для каждого вещества есть только одно номенклатурное название. Альдегиды, согласно номенклатуре, должны иметь суффикс «аль». Единственный, но весьма существенный минус таких названий - громоздкость. Например, обсуждавшийся в прошлый раз изо е супер согласно номенклатурным правилам должен называться «1-(1,2,3,4,5,6,7,8-октагидро-2,3,8,8,-тетраметил-2-нафтил)этанон-1». Трудно себе представить, во что бы превратились будни лабораторий, если бы химики пользовались только номенклатурными названиями («Василий, передайте, пожалуйста, вон ту колбу с цис-3-диметилметокси…»).
По этой причине чаще пользуются названиями тривиальными. Тривиальное название это как бы прозвище, nickname вещества. Оно ничего не говорит нам о строении и структуре, но оно короткое и запоминающееся. Ванилин, дихлофос, промедол, парабен - это всё тривиальные названия. Разные компании могут выпускать одно и то же соединение под разными названиями, обычно такие названия принято называть торговыми марками. 2ацетилоксибензойная кислота - это номенклатурное название, ацетилсалициловая кислота - тривиальное, а аспирин - торговая марка. Производители синтетических душистых веществ любят давать своим материалам яркие звучные названия. Часто альдегиды (с химической точки зрения) получают название с суффиксом «аль» на конце. Но зная любовь парфюмеров к альдегидам иногда названия с «аль» даются веществам, представляющим собой что-то совершенно иное. Например Clonal, продукт компании IFF, на самом деле нитрил, а Mystikal, каптивный материал компании Givaudan - карбоновая кислота. По сути, тот же трюк, что и с «альдегидом С-14».
(для простейшего альдегида R=H)
Классификация альдегидов
По строению углеводородного радикала:
Предельные; например:

Непредельные; например:

Ароматические; например:

Алициклические; например:

Общая формула предельных альдегидов

Гомологический ряд, изомерия, номенклатура

Альдегиды изомерны другому классу соединений - кетонам

например:

Альдегиды и кетоны содержат карбонильную группу ˃C=O, поэтому называются карбонильными соединениями.
Электронное строение молекул альдегидов
Атом углерода альдегидной группы находится в состоянии sp 2 -гибридизации, поэтому все σ-связи в этой группе располагаются в одной плоскости. Облака р-электронов, образующих π-связь, перпендикулярны этой плоскости и легко смещаются к более электроотрицательному атому кислорода. Поэтому двойная связь C=O (в отличие от двойной связи C=C в алкенах) сильно поляризована.
Физические свойства

Химические свойства
Альдегиды - реакционноспособные соединения, вступающие в многочисленные реакции. Наиболее характерны для альдегидов:
а) реакции присоединения по карбонильной группе; реагенты типа НХ присоединяются следующим образом:

б) реакции окисления связи C-H альдегидной группы, в результате которых образуются карбоновые кислоты:
I. Реакции присоединения
1. Гидрирование (образуются первичные спирты

2. Присоединение спиртов (образуются полуацетали и ацетали)

В избытке спирта в присутствии HCl полуацетали превращаются в ацетали:

II. Реакции окисления
1. Реакция «серебряного зеркала»

Упрощённо:

Эта реакция является качественной реакцией на альдегидную группу (на стенках реакционного сосуда образуется зеркальный налет металлического серебра).
2. Реакция с гидроксидом меди (II)

Эта реакция также является качественной реакцией на альдегидную групп у (выпадает красный осадок Сu 2 O).
Формальдегид окисляется различными O-содержащими окислителями сначала до муравьиной кислоты и далее - до Н 2 СO 3 (СO 2 + Н 2 O):

III. Реакции ди-, три- и полимеризации
1. Альдольная конденсация

2. Тримеризация ацетальдегида

3. Полимеризация формальдегида
При длительном хранении формалина (40%-ный водный раствор формальдегида) в нем происходит полимеризация с образованием белого осадка параформа:

IV. Реакция поликонденсации формальдегида с фенолом

Первая группа свойств реакции присоединения. В карбонильной группе между углеродом и кислородом присутствует двойная связь, которая, как вы помните, состоит из сигма-связи и пи-связи. В реакциях присоединения пи-связь рвется и образуются две сигма связи одна с углеродом, вторая с кислородом. На углероде сосредоточен частичный положительный заряд, на кислороде частичный отрицательный. Поэтому к углероду присоединяется отрицательно заряженная частица реагента, анион, а к кислород положительно заряженная часть молекулы.
Первое свойство гидрирование, присоединение водорода.
Реакция проходит при нагревании. Применяется уже известный вам катализатор гидрирования никель. Из альдегидов получаются первичные спирты, из кетонов вторичные.
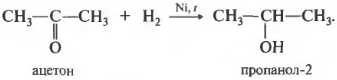
У вторичных спиртов гидроксогруппа связана со вторичным атомом углерода.
Второе свойство гидратация, присоединение воды. Эта реакция возможна только для формальдегида и ацетальдегида. Кетоны совсем не реагируют с водой.

Все реакции присоединения идут таким образом, что плюс идет к минусу, а минус к плюсу.
Как вы помните из видео про спирты , наличие двух гидроксогрупп у одного атома почти невозможная ситуация, такие вещества крайне неустойчивы. Так вот конкретно два этих случая гидрат формальдегида и уксусного альдегида возможны, хотя и существуют только в растворе.
Сами реакции знать не обязательно. Скорее всего, вопрос на экзамене может звучать как констатация факта, допустим, с водой реагируют и перечислены вещества. Среди их перечня которых могут быть метаналь или этаналь.
Третье свойство присоединение синильной кислоты.

Снова плюс идет к минусу, а минус к плюсу. Получаются вещества, называемые гидроксинитрилами. Опять же, сама реакция встречается нечасто, но знать об этом свойстве нужно.
Четвертое свойство присоединение спиртов.
Здесь снова не нужно знать наизусть уравнение реакции, просто надо понимать, что такое взаимодействие возможно.

Как обычно в реакциях присоединения к карбонильной группе плюс к минусу, а минус к плюсу.
Пятое свойство реакция с гидросульфитом натрия.

И снова, реакция довольно сложная, выучить ее вряд ли получится, но это одна из качественных реакций на альдегиды, потому что полученная натриевая соль выпадает в осадок. То есть по факту вы должны знать, что альдегиды реагируют с гидросульфитом натрия, этого будет достаточно.
На этом закончим с первой группой реакций. Вторая группа реакции полимеризации и поликонденсации.
2. Полимеризация и поликонденсация альдегидов
С полимеризацией вы знакомы: полиэтилен, бутадиеновый и изопреновый каучуки, поливинилхлорид это продукты объединения множества молекул (мономеров) в одну большую, в единую полимерную цепь. То есть получается один продукт. При поликонденсации происходит то же самое, но помимо полимера получаются еще низкомолекулярные продукты, например, вода. То есть получается два продукта.
Итак, шестое свойство полимеризация. Кетоны в эти реакции не вступают, промышленное значение имеет только полимеризация формальдегида.
Пи-связь рвется и образуются две сигма связи с соседними мономерами. Получается полиформальдегид, называемый также параформ. Вероятнее всего, вопрос на экзамене может звучать так: в реакции полимеризации вступают вещества. И приведен список веществ, среди которых может быть в формальдегид.
Седьмое свойство поликонденсация. Еще раз: при поликонденсации помимо полимера получается еще низкомолекулярное соединение, например, вода. Формальдегид вступает в такую реакцию с фенолом. Для наглядности сначала запишем уравнение с двумя молекулами фенола.
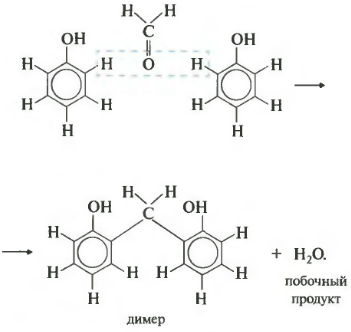
В результате получается такой димер и отщепляется молекула воды. Теперь запишем уравнение реакции в общем виде.

Продуктом поликонденсации является феноло-формальдегидная смола. Она находит широкое применение от клеев и лаков до пластмасс и компонента древесно-стружечных плит.
Теперь третья группа свойств реакции окисления.
3. Окисление альдегидов и кетонов
Восьмой реакцией в общем списке является качественная реакция на альдегидную группу окисление аммиачным раствором оксида серебра. Реакция «серебряного зеркала». Скажу сразу, кетоны не вступают в эту реакцию, только альдегиды.

Альдегидная группа окисляется до карбоксильной, кислотной группы, но в присутствии аммиака, который является основание, сразу же происходит реакция нейтрализации и получается соль ацетат аммония. Серебро выпадает в осадок, покрывая пробирку изнутри и создавая зеркальную поверхность. Эта реакция встречается на ЕГЭ постоянно.
Кстати, эта же реакция является качественной на другие вещества, имеющие альдегидную группу, например, на муравьиную кислоту и ее соли, а также на глюкозу.
Девятая реакция тоже качественная на альдегидную группу окисление свежеосажденным гидроксидом меди два. Здесь тоже замечу, что кетоны не вступают в эту реакцию.

Визуально будет наблюдаться сначала образование желтого осадка, который потом становится красным. В некоторых учебниках встречается информация, что сначала образуется гидроксид меди один, имеющий желтый цвет, который затем распадается на красный оксид меди один и воду. Так вот это неверно по последним данным в процессе выпадения осадка меняется размер частиц оксида меди один, которые в конечном счете достигают размеров, окрашенных именно в красный цвет. Альдегид окисляется до соответствующей карбоновой кислоты. Реакция встречается на егэ очень часто.
Десятая реакция окисление альдегидов подкисленным раствором перманганата калия при нагревании.
Происходит обесцвечивание раствора. Альдегидная группа окисляется до карбоксильной, то есть альдегид окисляется до соответствующей кислоты. Для кетонов эта реакция не имеет практического смысла, поскольку происходит разрушение молекулы и в результате получается смесь продуктов.
Важно отметить, что муравьиный альдегид, формальдегид, окисляется до углекислого газа, потому как соответствующая ему муравьиная кислота сама не устойчива к действию сильных окислителей.
В итоге углерод переходит из степени окисления 0 в степень окисления +4. Напомню, что и метанол, как правило, в таких условиях окисляется по максимуму до CO 2 , проскакивая стадию и альдегида, и кислоты. Эту особенность надо запомнить.
Одиннадцатая реакция горение, полное окисление. И альдегиды, и кетоны сгорают до углекислого газа и воды.
Запишем уравнение реакции в общем виде.
По закону сохранения массы атомов слева должно быть столько же, сколько атомов справа. Потому что ведь в химических реакциях атомы никуда не деваются, а просто изменяется порядок связей между ними. Так вот молекул углекислого газа будет столько же, сколько и атомов углерода в молекуле карбонильного соединения, поскольку в состав молекулы входит один атом углерода. То есть n молекул CO 2 . Молекул воды будет в два раза меньше, чем атомов водорода, то есть 2n/2, а значит просто n.
Атомов кислорода слева и справа одинаковое количество. Справа их 2n из углекислого газа, потому что в каждой молекуле два атома кислорода, плюс n воды, итого 3n. Слева атомов кислорода столько же 3n, но один из атомов находится в молекуле альдегида, значит его надо вычесть из общего количества, чтобы получить количество атомов, приходящихся на молекулярный кислород. Выходит 3n-1 атомов содержит молекулярный кислород, а значит молекул в 2 раза меньше, потому как в состав одной молекулы входят 2 атома. То есть (3n-1)/2 молекул кислорода.
Таким образом, мы составили уравнение сгорания карбонильных соединений в общем виде.
И, наконец, двенадцатое свойство, относящееся к реакциям замещения галогенирование по альфа-атому углерода. Еще раз обратимся к строению молекулы альдегида. Кислород оттягивает на себя электронную плотность, создавая частичный положительный заряд а углероде. Метильная группа пытается компенсировать этот положительный заряд, смещая к нему электроны от водорода по цепи сигма-связей. Связь углерод-водород становится более полярной и водород легче отрывается при атаке реагентом. Такой эффект наблюдается только для альфа-атома углерода, то есть атома следующего за альдегидной группой, вне зависимости от длины углеводородного радикала.
Таким образом, возможно получение, например, 2-хлорацетальдегида. Возможно дальнейшее замещение атомов водорода до трихлорэтаналя.









